국내 수입·유통된 제품 3330대
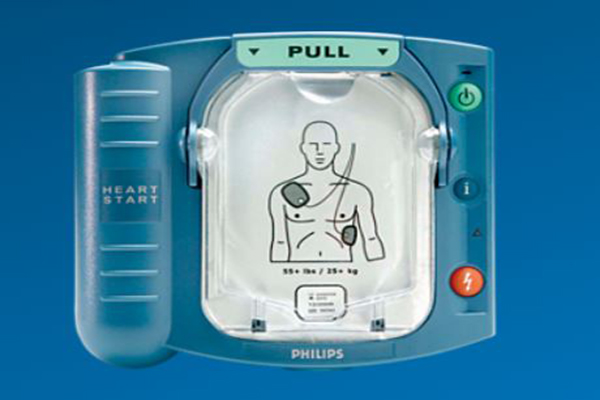
[컨슈머와이드-신동찬 기자] 식품의약품안전처(식약처)는 부품 불량으로 오작동 우려가 있는 것으로 확인된 필립스 저출력심장충격기에 대해 전수조사에 나선다고 16일 밝혔다.
식약처에 따르면, 부품 불량으로 오작동 우려가 발견된 제품은 필립스메디컬시스템즈(Philips Medical Systems, 미국 소재)가 지난 2002년부터 2013년까지 생산하여 전 세계 판매한 저출력심장충격기 2개 모델(861304 HeartStart FRx Defibrillator, HeartStart HS1)이다. 현재 국내에 수입·유통된 제품은 3330대로 주로 의료기관 및 공공장소에 설치돼 있다.
현재까지 국내에서 해당제품 부품 불량으로 인해 보고된 부작용은 없는 것으로 알려졌다. 이번 전수조사는 필립스메디컬시스템즈가 미국, 유럽, 일본, 호주 등 전 세계적인 조치에 따른 것으로 국내에서는 예방차원에 가깝다.
이번 전수조사는 필립스코리아가 오는 5월 31일까지 진행한다. 또한 이업체는 안전사용안내에도 나선다. 안전 사용 안내 주요 내용은 전수 점검 기간 동안 제품을 사용할 때 삼중 경고음이 울릴 경우 안내(information)를 의미하는 ‘i’ 표시 버튼을 누르면 음성 메시지가 나오고 배터리 1회 탈·부착 등 안내하는 조치 사항을 따르면 된다. 미작동 중인 제품에서 삼중경고음이 울릴 경우에는 즉시 필립스코리아 고객센터에 연락하면 된다.
한편, 우리나라에서 저출력심장충격기는 79건(제조 29, 수입 50) 허가되어 있다. 최근 3년 동안 국내에서 제조된 제품은 10만3150대, 수입된 제품은 1만8134대다.

